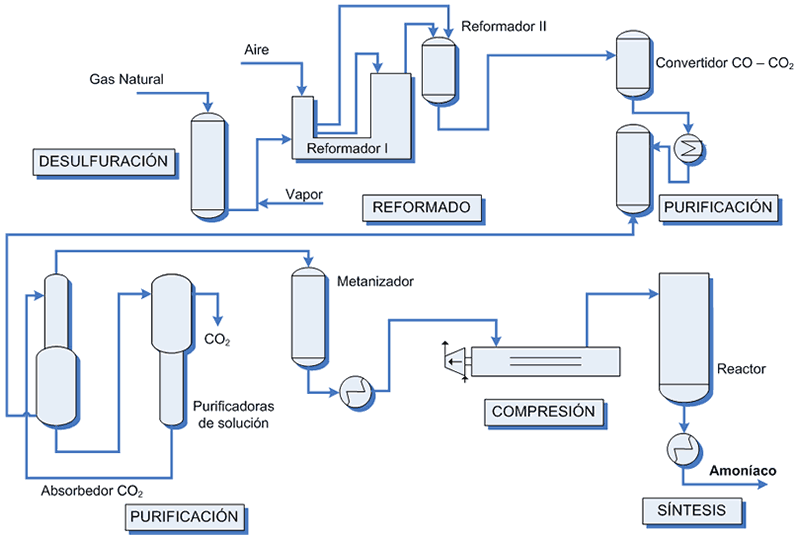
imagen de los Esquemas de los procesos de Sintesis y fabricación del amoniaco NH3
Síntesis de amoníaco
Así se obtiene un gas de síntesis con restos de CH4 y Ar que actúan como inertes.
A continuación el gas se comprime a la presión de 200 atm. Aproximadamente (compresor centrífugo con turbina de vapor) y se lleva al reactor donde tiene lugar la producción del amoníaco, sobre un lecho catalítico de Fe.
A continuación el gas se comprime a la presión de 200 atm. Aproximadamente (compresor centrífugo con turbina de vapor) y se lleva al reactor donde tiene lugar la producción del amoníaco, sobre un lecho catalítico de Fe.
N2 (g) + 3 H2 (g)  2 NH3 (g)
2 NH3 (g)
en un solo paso por el reactor la reacción es muy incompleta con un rendimiento del 14-15%. Por tanto, el gas de síntesis que no ha reaccionado se recircula al reactor pasando antes por dos operaciones,
- a) extracción del amoníaco mediante una condensación.
- b) eliminación de inertes mediante una purga, la acumulación de inertes es mala para el proceso. El gas de purga se conduce a la unidad de recuperación
Ar para comercializarse
CH4 se utiliza como fuente de energía
N2 y H2 se introducen de nuevo en el bucle de síntesis
El amoníaco se almacena en un tanque criogénico a -33ºC, el amoníaco que se evapora (necesario para mantener la temperatura) se vuelve a introducir en el tanque.
Usos del amoniaco
La mayor parte del amoniaco (80%) se destina a la fabricación de fertilizantes, como- nitrato amónico: NH4NO3
- sales amónicas: (NH4)2SO4 , (NH4)3PO4
- urea: (NH2)2C=O
Otros usos del amoníaco incluyen:
- Fabricación de HNO3. Explosivos y otros usos.
- Caprolactama, nylon
- Poliuretanos
- Gas criogénico por su elevado poder de vaporización.
- Productos de limpieza domésticos tales como limpiacristales.

No hay comentarios:
Publicar un comentario